- 글로벌 임상3상(MATTERHORN) 중간 분석…표준 항암요법 대비 EFS·OS 모두 개선
- 임핀지 바카라사이트 승리바카라 소울카지노군, 수술 후 단독 유지요법까지 포함…EFS 중앙값 도달 안 해
- “환자 3명 중 2명, 2년 이상 재발 없이 생존”…2년 무사건 생존 67%

[더바이오 이영성기자] 다국적 제약사 아스트라제네카(AZ)의 면역항암제인 ‘임핀지(Imfinzi, 성분더발루맙)’를 기반으로 한 수술 전후 바카라사이트 승리바카라 소울카지노이 조기 위암 치료에서 의미 있는 성과를 거둔 것으로 나타났다.
이번 연구 결과는 1일(현지시간) 미국 시카고에서 열리고 있는 미국임상종양학회 연례 학술대회(바카라사이트 승리바카라 소울카지노 2025) 플레너리 세션에서 발표됐으며, 국제학술지인 뉴잉글랜드저널오브메디슨(NEJM)에도 함께게재됐다.
이번 발표는 아스트라제네카가 진행한 글로벌 임상3상(MATTERHORN)연구의 중간 분석 결과다. 해당 연구는 수술이 가능한 조기 또는 국소 진행성(Stage II~IVA) 바카라사이트 승리바카라 소울카지노 및 위식도접합부(GEJ)암 환자를 대상으로 진행됐다.
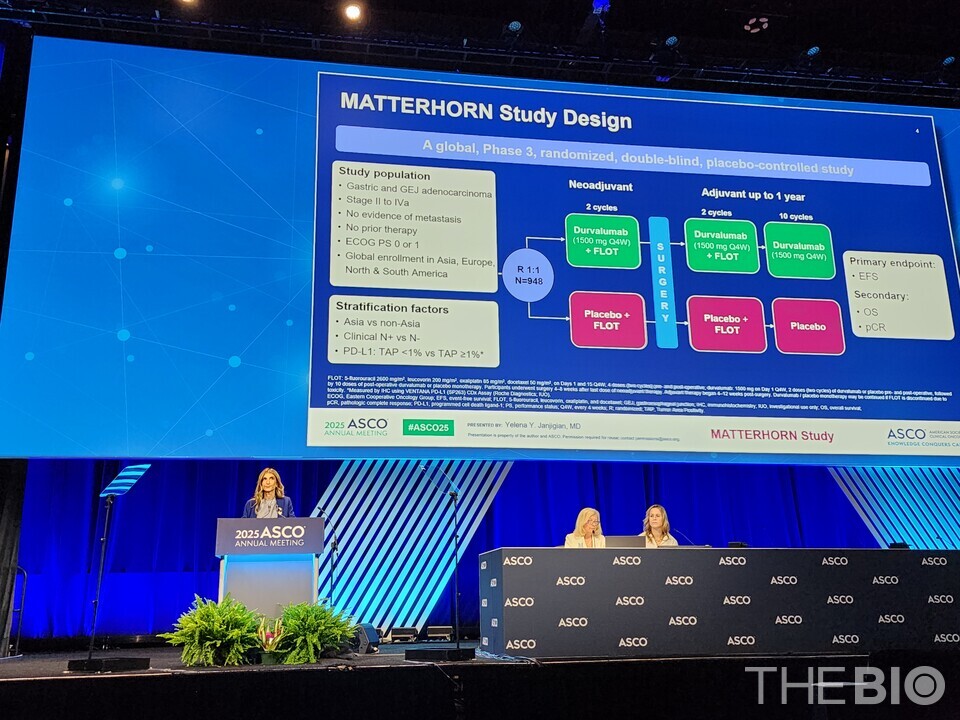
해당 연구는 기존 표준 항암화학요법인 ‘플루오로우라실, 류코보린, 옥살리플라틴, 독세탁셀 병용요법(FLOT)’에 면역항암제인 임핀지를 추가한 수술 전후 치료 전략의 효과를 평가했다. 총 948명의 환자가 무작위로 2개 집단에 배정됐으며, 각각 474명이 임핀지 병용군과 대조군으로 나눠졌다. 임핀지 병용군은 수술 전 임핀지와 항암화학요법을 병용한 신보조요법을 받은 뒤, 수술 후에도 동일한 병용요법을 일정 기간 유지하고 이후에는 임핀지를 단독으로 투여받았다. 대조군은 수술 전후 모두 표준 항암화학요법만을 투여받았다.
중간 분석 결과, 임핀지 바카라사이트 승리바카라 소울카지노은 대조군에 비해 질병 진행, 재발 또는 사망 위험을 유의미한 수준으로 약 29% 감소시킨 것으로 나타났다. 특히 임핀지 병용군의 경우, 치료 1년 후 질병 진행이나 재발, 사망 없이 생존한 비율은 78.2%, 2년 후에는 67.4%로 나타났다. 이는 각각 대조군의 74.0%, 58.5%보다 높은 수치로, 시간이 지날수록 2개군 간 치료 효과의 격차가 더 커지는 양상을 보였다. 또임핀지 병용군은 아직 무사건 생존기간(event-free survival, EFS)의 중앙값에 도달하지 않았지만, 대조군의 경우 EFS가 약 32.8개월로 추정됐다.
2차 평가지표인 전체 생존기간(OS)에서도 임핀지 병용군은 사망 위험이 대조군보다 약 22% 낮은 것으로 나타났다. 연구팀은 최종 분석을 통해 생존율 개선 효과를 추가로 검증할 계획이다.
미국 메모리얼 슬론 케터링 암센터(Memorial Sloan Kettering Cancer Center)의 소화기 종양학 서비스(Gastrointestinal Oncology Service) 책임자인 옐레나 얀지기언(Yelena Y. Janjigian) 의학 교수는 “결론적으로 ‘더발루맙과 FLOT’ 바카라사이트 승리바카라 소울카지노은 절제 가능한 위암 및 위식도접합부암 환자에서 EFS를 개선시켰으며, 이러한 EFS 이점은 하위 그룹 및 지역별 분석에서도 일관되게 나타났다”며 “추가적인 안전성 문제는 확인되지 않았다”고 밝혔다.
그는 이어 “OS 데이터도 고무적이며, 최종 분석은 진행 중”이라며 “Matterhorn 연구는 더발루맙 바카라사이트 승리바카라 소울카지노이 국소 진행성 위암 및 위식도접합부암 환자를 위한 새로운 표준 치료로서 수술 전후(perioperative) 치료법에 채택될 수 있는 근거를 제공한다”고 덧붙였다.
한편 임핀지는 PD-L1 단백질에 결합해 PD-L1과 면역 억제 관련 단백질인 PD-1 및 CD80 간의 상호작용을 차단함으로써 암세포의 면역 회피를 억제하고 면역 반응을 활성화하는 면역항암제다. 임핀지는 지난 2017년 처음 허가된 이후 비소세포폐암(NSCLC), 간세포암, 담도암, 자궁내막암 등 다양한 고형암에서 단독 또는 바카라사이트 승리바카라 소울카지노으로 승인받아왔다. 이번 연구를 통해 위암 및 위식도접합부(GEJ)암의 조기 단계에서도 바카라사이트 승리바카라 소울카지노의 적용 가능성을 확인했으며, 아스트라제네카는 해당 적응증 확대를 위한 허가 절차에 나설 것으로 전망된다.


